El Comité Asesor de Prácticas de Inmunización de los Centros para el Control y la Prevención de Enfermedades de EEUU (CDC, por sus siglas en inglés) votó a favor de recomendar la vacuna contra el coronavirus de Pfizer – BioNTech en personas de 16 años o más, despejando así otro obstáculo fundamental para el fármaco antes de que comiencen las vacunaciones el próximo lunes.
El Comité, un grupo externo de expertos médicos que asesora a la agencia, votó 11 a 0 recomendando la vacuna para su uso en personas de 16 años o más bajo la autorización de emergencia de la Administración de Drogas y Alimentos. Ahora, la recomendación será enviada al director del CDC, Robert Redfield, quien deberá firmarla antes de que empiecen las vacunaciones.
Los integrantes de este comité señalaron que su evaluación de la vacuna fue independiente y transparente. “Creo que el proceso que hemos utilizado para llegar a esta decisión es transparente, está basado en la ciencia, tiene en cuenta la equidad y es, en este momento, lo mejor que podemos hacer”, aseguró Beth Bell, profesora clínica de salud global en la Universidad de Washington.
Los asesores basaron la recomendación de hoy en las pruebas científicas que respaldan la vacuna, incluidos los datos de un estudio clínico de fase 3 anunciado el mes pasado y publicado en The New England Journal of Medicine el 10 de diciembre de 2020, así como en la orientación provisional que el CDC hizo el 1 de diciembre pasado con respecto a la asignación de las dosis iniciales de la vacuna.
“La recomendación marca un paso trascendental en este viaje histórico y el comienzo de otro, ya que trabajamos conjuntamente con el gobierno de los EEUU, otras compañías de vacunas y nuestros muchos socios para ejecutar el programa de vacunación masiva más grande en la historia de nuestra nación. Colectivamente, nos proponemos vacunar a cientos de millones de estadounidenses para fines de 2021”, dijo Albert Bourla, Presidente y Director Ejecutivo de Pfizer. “Con las vacunas a punto de comenzar esta semana, siento un gran orgullo por lo que hemos logrado colectivamente en los últimos nueve meses. Ahora espero el día en que esta devastadora y mortal pandemia quede finalmente atrás”, agregó.
“Iniciamos nuestro proyecto para desarrollar una potencial vacuna COVID-19 en enero porque sentimos que teníamos el deber de aprovechar nuestras tecnologías de ARNm y nuestras competencias de desarrollo rápido de vacunas para ayudar a hacer frente a la pandemia”, afirmó Ugur Sahin, director general y cofundador de BioNTech. “Tenemos el mayor respeto por todos los trabajadores de la salud y las personas que trabajan día y noche en instalaciones de cuidados a largo plazo y hospitales. Ellos han estado cuidando a tantas personas que necesitaban ayuda. Ahora, nos sentimos honrados de poder apoyarlos proporcionando esta vacuna”
Los primeros lotes de la vacuna Pfizer/BioNTech contra el COVID-19, aprobada por las autoridades sanitarias de Estados Unidos el viernes, llegarán a los centros de inoculación de todo el país el próximo lunes por la mañana, anunciaron las autoridades estadounidenses el sábado.:quality(85)//cloudfront-us-east-1.images.arcpublishing.com/infobae/UISLTWQHUBAM5NIGF537SNKCJE.jpg) En la primera etapa se vacunaran a 3 ,millones de personas en EEUU (REUTERS)
En la primera etapa se vacunaran a 3 ,millones de personas en EEUU (REUTERS)
“Se espera que 145 sitios de todos los estados reciban la vacuna el lunes, otros 425 sitios, el martes, y los 66 sitios finales, el miércoles, lo que completaría la entrega inicial de la vacuna Pfizer-BioNTech”, dijo el general Gus Perna, miembro del operativo gubernamental para afrontar la pandemia.
La primera etapa contempla la vacunación de unos tres millones de personas.
“Hoy es el día D. Es el día en que comienza la misión. En el pasado fue el comienzo del fin de la II Guerra Mundial y ahora será el comienzo del fin de la pandemia”, indicó en la rueda de prensa el militar que ha liderado la planificación de la distribución de las vacunas por todo el país. “Ahora mismo están siendo empaquetadas y comenzarán a salir mañana por la mañana de las instalaciones de fabricación”, añadió el uniformado. “Vamos a tener una cadencia constante de entrega de vacunas”, aseguró el general, quien recordó como sucedió en la II Guerra Mundial “quedarán duras batalla por delante hasta alcanzar la victoria”.
La operación contará con la colaboración del gobierno Federal, Pfizer, operadores logísticos como Fedex y UPS, así como las autoridades sanitarias de los estados, que serán responsables de la administración final de la vacuna y determinar qué cantidades de dosis requieren.
Perna dijo que para finales de diciembre esperan distribuir por todo el país 40 millones de dosis, que se asignarán a los estados en base a sus necesidades para cubrir a los grupos prioritarios designados por los Centros de Control y Prevención de Enfermedades (CDC).
La vacuna llega en momentos en los que Estados Unidos registra cifras diarias récord de casos y muertes, con 3.309 fallecidos y 231.775 nuevos casos de coronavirus en las últimas 24 horas.
Así funciona el desarrollo de Pfizer
La fórmula que se administrará está basada en la tecnología del ARN mensajero, la misma que la candidata Moderna, que lleva instrucciones de ADN para que las células del cuerpo humano generen ciertas proteínas protectoras. La eficacia del 95% frente al virus SARS-CoV-2 se logró siete días después de la segunda dosis de vacuna y 28 días después de la primera. Debido al reciente comienzo de los estudios, no es posible saber cuánto tiempo dura la inmunidad.
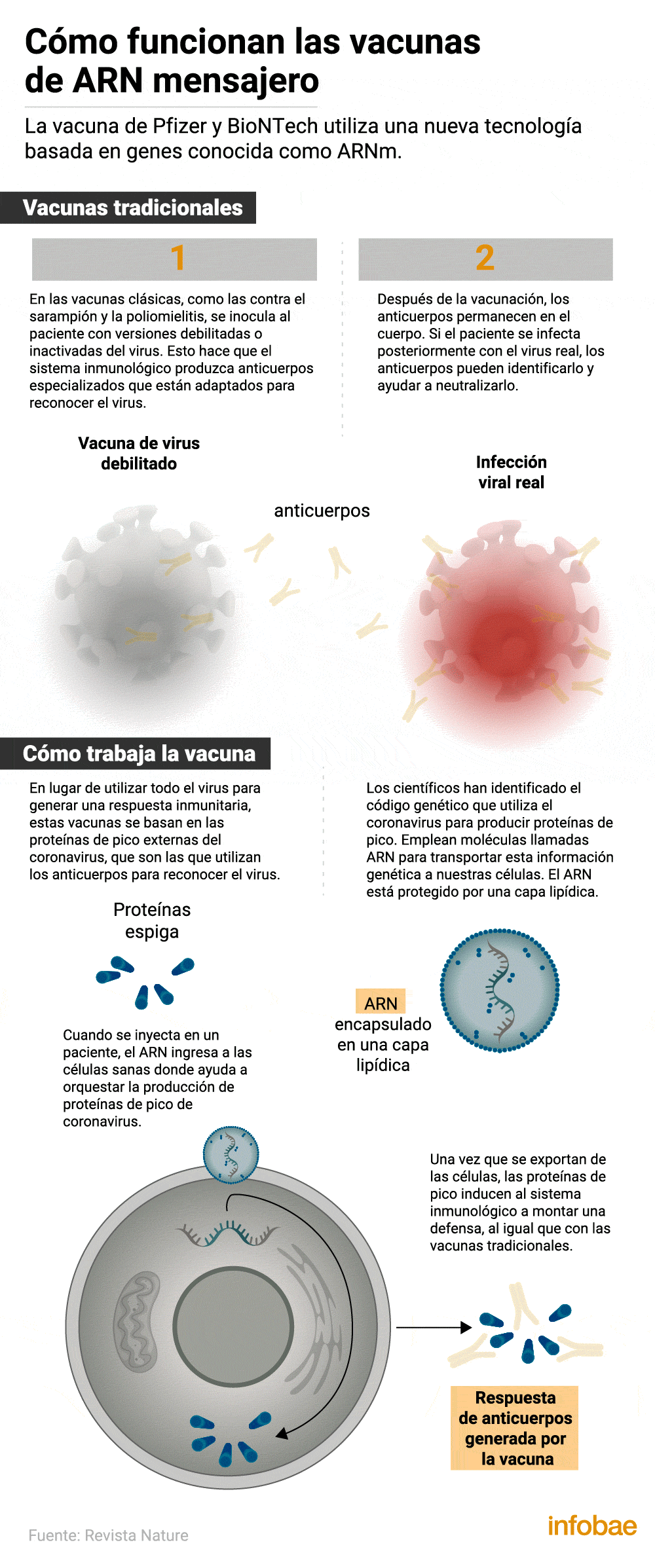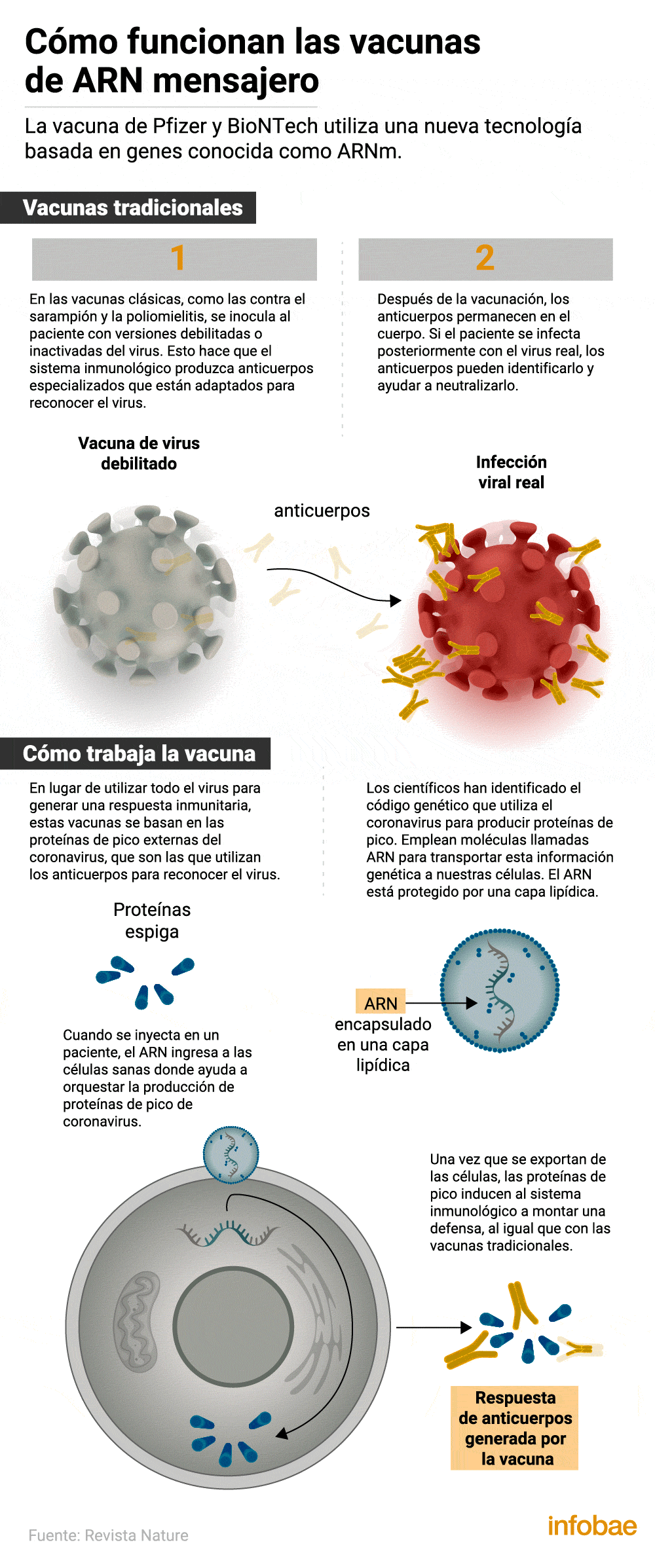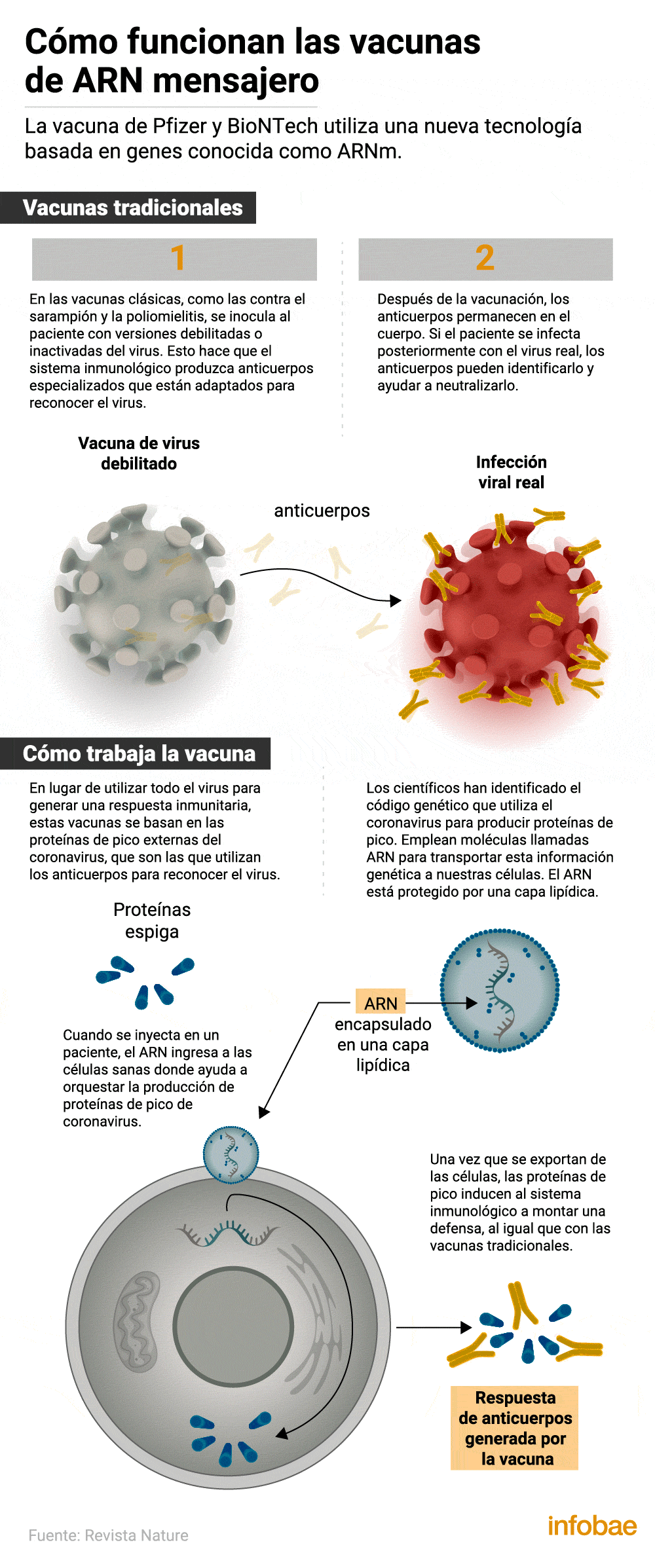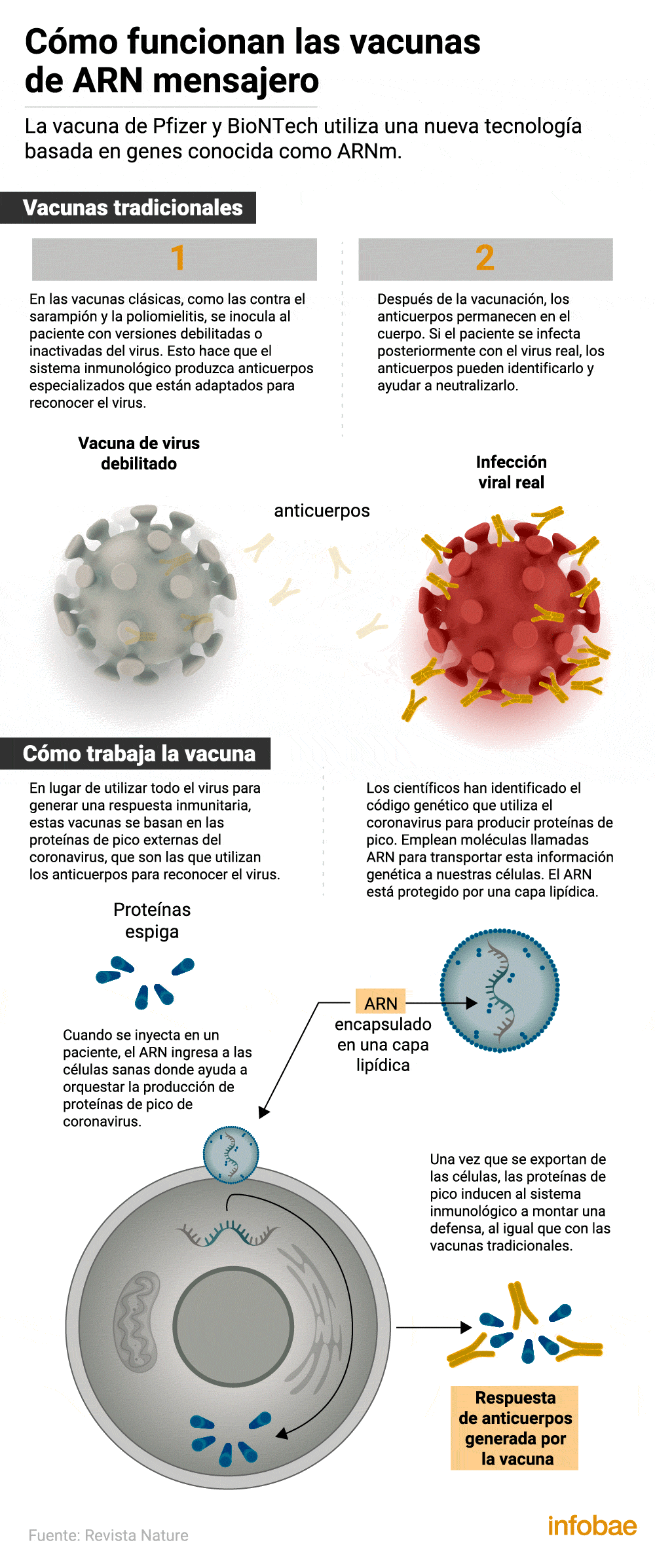
Los avisos de seguridad sobre esta vacuna:
– La vacuna no puede administrarse a personas con antecedentes conocidos de reacciones alérgicas graves (por ejemplo, anafilaxia) a cualquier componente de la vacuna Pfizer BioNTech COVID-19.
– Las personas inmunocomprometidas, incluidos los individuos que reciben terapia inmunosupresora, pueden tener una respuesta inmunológica disminuida a la vacuna COVID-19 de Pfizer BioNTech.
– La vacuna COVID-19 de Pfizer BioNTech puede no proteger a todos los receptores de la vacuna
– En los estudios clínicos, las reacciones adversas en los participantes de 16 años de edad y mayores incluyeron dolor en el lugar de la inyección (84,1%), fatiga (62,9%), dolor de cabeza (55,1%), dolor muscular (38,3%), escalofríos (31,9%), dolor articular (23,6%), fiebre (14,2%), hinchazón en el lugar de la inyección (10,5%), enrojecimiento en el lugar de la inyección (9,5%), náuseas (1,1%), malestar (0,5%) y linfadenopatía (0,3%).
– Se han reportado reacciones alérgicas severas después de la vacuna COVID-19 de Pfizer-BioNTech durante la vacunación masiva fuera de los ensayos clínicos. Reacciones adversas adicionales, algunas de las cuales pueden ser graves, pueden hacerse evidentes con un uso más extendido de la vacuna Pfizer-BioNTech COVID-19.
– Los datos disponibles sobre la vacuna COVID-19 de Pfizer BioNTech administrada a mujeres embarazadas son insuficientes para informar sobre los riesgos asociados a la vacuna en el embarazo.
– No se dispone de datos para evaluar los efectos de la vacuna COVID-19 de Pfizer BioNTech en el lactante o en la producción de leche/excreción
– No hay datos disponibles sobre la intercambiabilidad de la vacuna COVID 19 de Pfizer BioNTech con otras vacunas COVID 19 para completar la serie de vacunas. Los individuos que han recibido una dosis de la vacuna Pfizer BioNTech COVID-19 deben recibir una segunda dosis de la vacuna Pfizer BioNTech COVID-19 para completar la serie de vacunación.
– Los proveedores de vacunas deben revisar la hoja informativa para conocer los requisitos obligatorios y la información que debe proporcionarse a los receptores de vacunas/cuidadores y la información completa de prescripción de la EUA para conocer los requisitos e instrucciones para informar sobre eventos adversos y errores de administración de la vacuna.
















